Metabolismus des Fettgewebes
Adipozyten spielen eine herausragende Rolle in Energiehomöostase und Metabolismus. Sie sind der wichtigste Energiespeicher in Säugetieren. Neben den weißen Fettzellen, die Energie speichern, gibt es aber auch Fettzellen die darauf spezialisiert sind, Energie in Form von Wärme abzugeben. Diese Fettzellen werden als „braune“ Fettzellen bezeichnet. Die biologische Funktion von braunen Fettzellen ist die zitterfreie Thermogenese, die vor allem für die Wärmeerzeugung von Neugeborenen wichtig ist. Braunes Fett konnte aber auch in Erwachsenen nachgewiesen werden und eine große Studie an Erwachsenen zeigte, dass braunes Fett die kardiovaskuläre Gesundheit fördert.
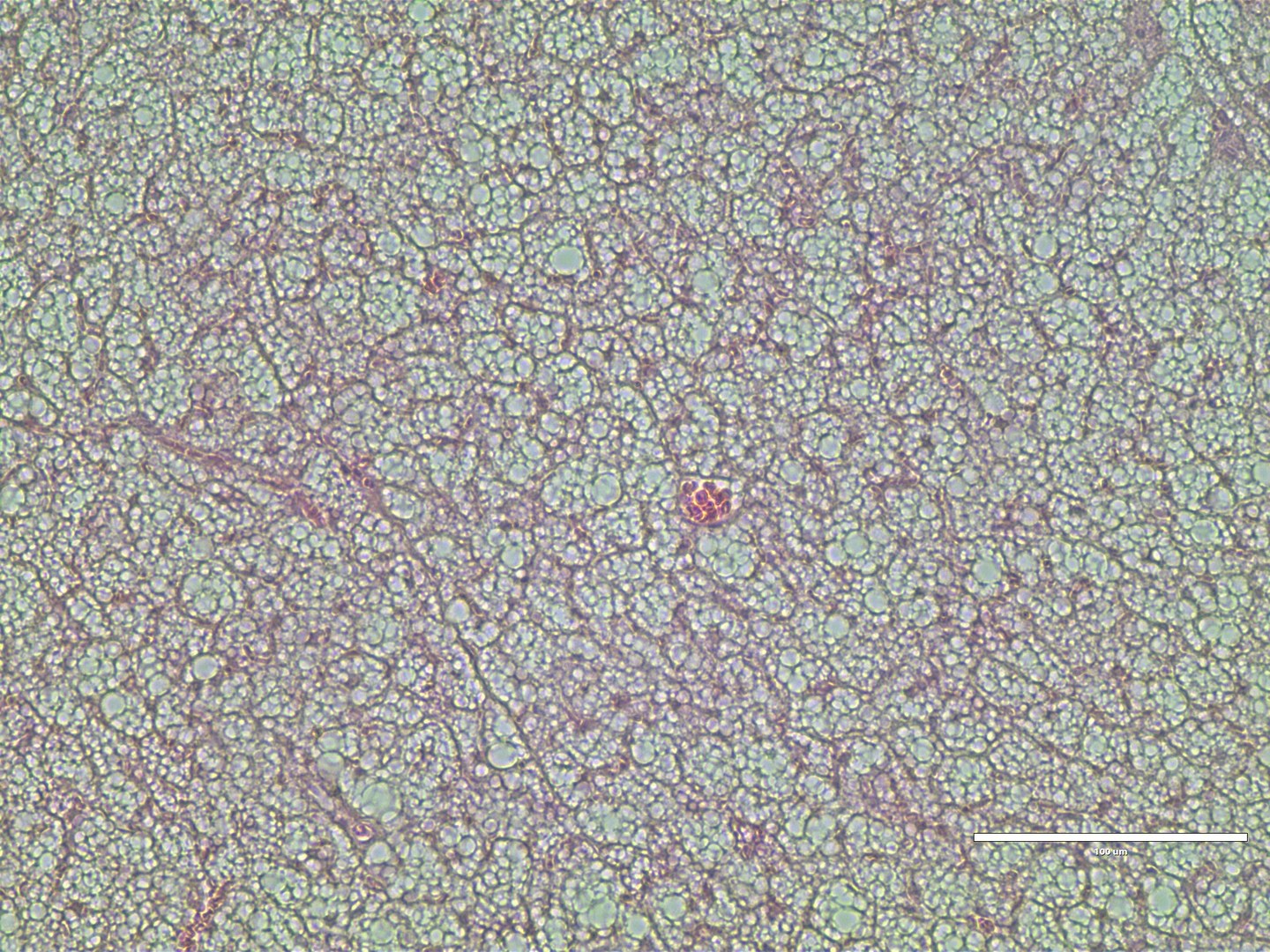
Im rechts abgebildeten Bild zu sehen ist eine histologische Färbung von braunem Fettgewebe nach 12 Wochen Hochfettdiät (HE Färbung).
Virale Vektoren und Nanomedizin
Virale Vektoren
Unser Ziel ist es, moderne Virologie mit transgenen Technologien zu kombinieren. Lentivirale Vektoren sind ein vielversprechendes Werkzeug in der Molekularbiologie und Gentherapie. Lentiviren sind dazu in der Lage, sich nicht teilende Zellen in vitro und in vivo effizient zu transduzieren, wie z.B. Neurone, Hepatozyten und Muskelzellen. Ausserdem können diese Vektoren auch zum Gentransfer in Stammzellen wie den embryonale Stammzellen (ES-Zellen) verwendet werden. Wir und Andere haben Methoden etabliert, die den Gebrauch von lentiviralen Vektoren zur Generierung von transgenen Tieren ermöglichen (lentivirale Transgenese). Die Transduktion von Preimplantationsembryonen mit lentiviralen Vektoren resultiert in der Expression von lentiviral applizierten Transgenen während der Embryonalentwicklung und im neugeborenen und erwachsenen Tier. Die lentivirale Transgenese konnte mittlerweile für viele Tierarten wie den Mäuse, Schweine, Ratten, Rinder und Hühner etabliert werden.
Nanomedizin
Unser Ziel ist die Entwicklung von auf die Nanomedizin basierenden Strategien zum gezielten Transfer von innovativen Therapien wie z.B. genetischem Material (Nukleinsäuren und virale Vektoren) oder genetisch modifizierten Zellen (besonders Stamm- und Progenitorzellen) im kardiovaskulären System und zentralen Nervensystem. Diese Arbeiten werden im Rahmen der DFG-Forschergruppe 917 "Nanoguide" durchgeführt.
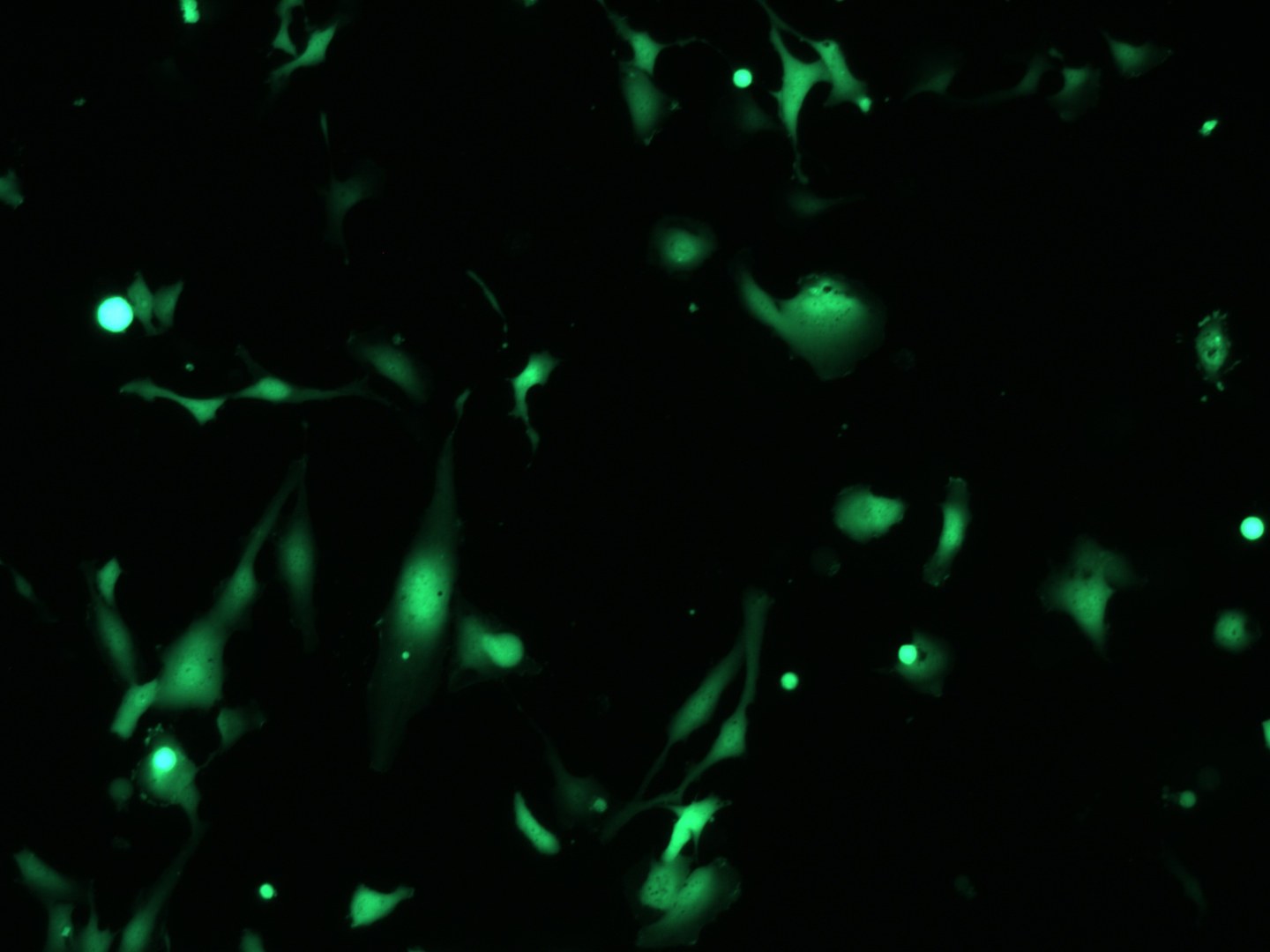
Im links abgebildeten Bild zu sehen sind GFP-exprimierende glatte Muskelzellen, die mit magnetischen Nanopartikel-gekoppelten lentiviralen Partikeln transduziert wurden.
GPCR- und Purinsignaling
G-Protein gekoppelte Rezeptoren regulieren eine Vielzahl physiologischer Prozesse. Darüber hinaus sind diese Rezeptoren und Ihre Liganden Zielstruktur für einen Großteil der gegenwärtig zugelassenen Pharmaka. Wir untersuchen GPCRs, ihre Liganden und assoziierte Signalwege vor allem im Kontext der Energie-Homöostase, des Metabolismus und des kardiovaskulären Systems.
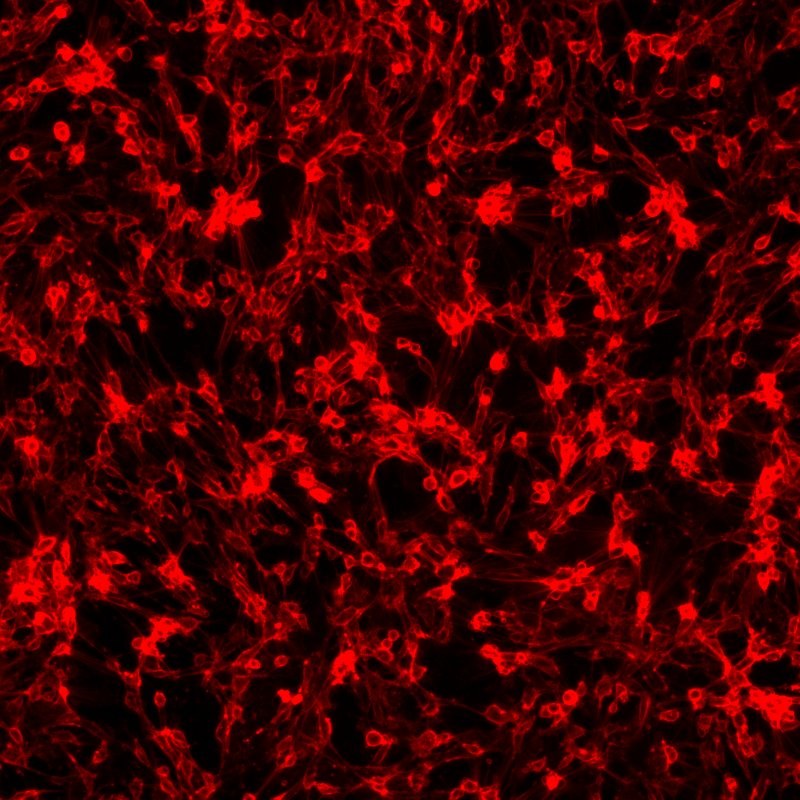
Im rechts abgebildeten Bild zu sehen ist eine immunzytochemische Färbung von murinen weißen Präadipozyten, die mit primären Antikörpern gegen Gpr81 und sekundären, mit Alexa Fluor 647 markierten Antikörpern, durchgeführt wurde.
NO/cGMP-Signaling
cGMP ist ein wichtiger sekundärer Botenstoff und vermittelt die biologischen Effekte von Stickstoffmonoxid (NO) sowie von natriuretischen Peptiden (z.B. atriales natriuretisches Peptid). Der cGMP Signalweg spielt eine herausragende Rolle bei der Regulation des Tonus der glatten Gefäßmuskulatur und damit des Blutdrucks. Darüber hinaus reguliert cGMP eine Vielzahl weiterer biologischer Prozesse. Uns interessiert dabei v.a. die Funktion des cGMP Signalwegs in Adipozyten und im Metabolismus.
Um diese Abläufe zu untersuchen nutzen wir, neben anderen biochemischen Methoden, auch genetisch kodierte fluoreszierende Biosensoren (wie z.B. Förster-Resonanzenergietransfer = FRET) und Biosensoren mit einzelnen Fluorophoren.
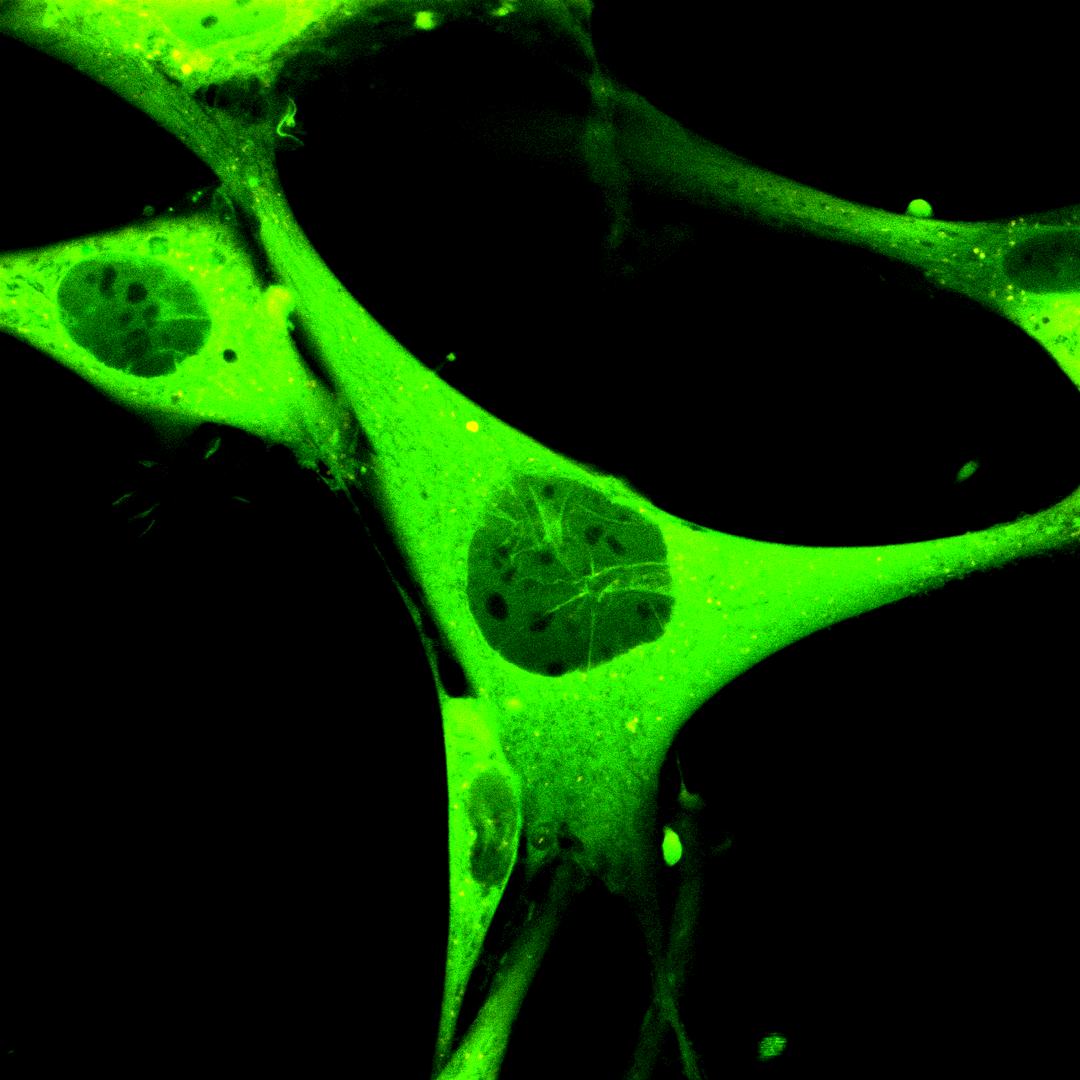
Links abgebildet ist eine braune Adipozytenvorläuferzelle (braune prä-Adipozyte), die aus einem transgenen Mausstamm isoliert wurde und ubiquitär den cGi-500 FRET-Biosensor exprimiert.
hiPSC derived brown adipose organoids
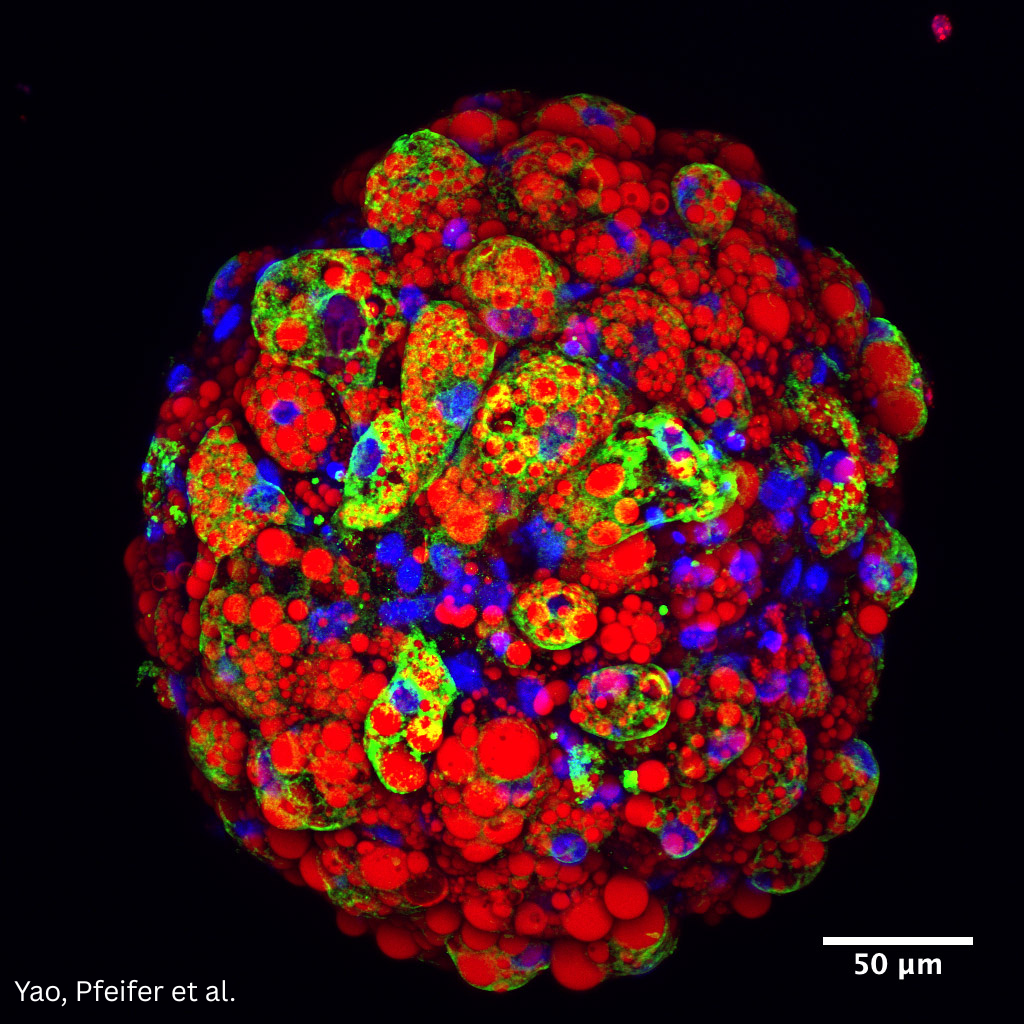
Unser Ziel ist es, hiPSC-abgeleitete braune Fettgewebe-Organoide (hiPSC-BAOs) als in-vitro-Modelle zu verwenden, um den Stoffwechsel des menschlichen braunen Fettgewebes (hBAT) zu untersuchen. Besonders interessiert uns die Regulation der Thermogenese in hiPSC-BAOs sowie der Austausch zwischen verschiedenen Zelltypen innerhalb der hiPSC-BAOs. Weitere Informationen finden Sie auch in Reverte et al., Nature Cell Biology 2024, DOI: https://doi.org/10.1038/s41556-023-01311-9
Abbildung: hiPSC-BAO mit UCP1 in grün, Oil Red O in rot und DAPI in blau.
Alexander Pfeifer beschäftigt sich seit langem mit zellulärer Signalgebung, molekularer Pharmakologie und akademischer Arzneimittelforschung. Er hat Pionierarbeit im Bereich der purinergen Signalgebung und des NO/cGMP-Signalwegs geleistet und wichtige Beiträge zum Forschungsgebiet der G-Protein-gekoppelten Rezeptoren erbracht. Seit mehreren Jahren untersucht er diese pharmakologisch relevanten Signalwege, um Wirkstofftargets zu identifizieren und neue Therapieansätze zu entwickeln. Ein Schwerpunkt seiner Forschung liegt auf Stoffwechselerkrankungen und der Energiehomöostase. Er ist Sprecher des DFG-geförderten Sonderforschungsbereichs SFB/TRR333 „BATenergy“.
Ein weiteres wichtiges Thema seiner Forschung ist der Gen- und Wirkstofftransport. Dabei konzentriert er sich auf lentivirale Vektoren und Nanopartikel, um genetisches Material beziehungsweise Wirkstoffmoleküle gezielt in spezifische Zellen und Gewebe zu transportieren. Er war zudem Sprecher der DFG-Forschergruppe FOR917 sowie des DAAD-Strategischen Netzwerks Europa-Japan im Bereich multimodaler Nanopartikel.

Nature Cell Biology
EPAC1 enhances brown fat growth and beige adipogenesis
Reverte-Salisa, L., Siddig, S., Hildebrand, S. et al. EPAC1 enhances brown fat growth and beige adipogenesis. Nat Cell Biol 26, 113–123 (2024). https://doi.org/10.1038/s41556-023-01311-9
Nature
Brown adipose tissue (BAT) dissipates energy and promotes cardio-metabolic health. In this publication, Nieman et al identifiy inosine as novel tissue-messenger in brown fat (BAT). They show that treatment of mice with inosine increased BAT-dependent energy expenditure and induced “browning” of white adipose tissue. This work is funded by the DFG.
Niemann, B., Haufs-Brusberg, S., Puetz, L. et al. Apoptotic brown adipocytes enhance energy expenditure via extracellular inosine. Nature (2022). https://doi.org/10.1038/s41586-022-05041-0
Communications Biology
Copperi F, Schleis I, Roumain M, Muccioli GG, Casola S, Klingenspor M, Pfeifer A, Gnad T. EBI2 is a negative modulator of brown adipose tissue energy expenditure in mice and human brown adipocytes.
Commun Biol. 2022 Mar 29;5(1):280. doi: 10.1038/s42003-022-03201-6. PMID: 35351968
Communications Biology
Hildebrand S, Ibrahim M, Schlitzer A, Maegdefessel L, Röll W, Pfeifer A. PDGF regulates guanylate cyclase expression and cGMP signaling in vascular smooth muscle.
Commun Biol. 2022 Mar 3;5(1):197. doi: 10.1038/s42003-022-03140-2. PMID: 35241778
Cell
Sveidahl Johansen O, Ma T, Hansen JB, Markussen LK, Schreiber R, Reverte-Salisa L, Dong H, Christensen DP, Sun W, Gnad T, Karavaeva I, Nielsen TS, Kooijman S, Cero C, Dmytriyeva O, Shen Y, Razzoli M, O'Brien SL, Kuipers EN, Nielsen CH, Orchard W, Willemsen N, Jespersen NZ, Lundh M, Sustarsic EG, Hallgren CM, Frost M, McGonigle S, Isidor MS, Broholm C, Pedersen O, Hansen JB, Grarup N, Hansen T, Kjær A, Granneman JG, Babu MM, Calebiro D, Nielsen S, Rydén M, Soccio R, Rensen PCN, Treebak JT, Schwartz TW, Emanuelli B, Bartolomucci A, Pfeifer A, Zechner R, Scheele C, Mandrup S, Gerhart-Hines Z. Lipolysis drives expression of the constitutively active receptor GPR3 to induce adipose thermogenesis.
Cell. 2021 Jun 24;184(13):3502-3518.e33. doi: 10.1016/j.cell.2021.04.037. Epub 2021
ACS Nano
Hildebrand S, Löwa N, Paysen H, Fratila RM, Reverte-Salisa L, Trakoolwilaiwan T, Niu Z, Kasparis G, Preuss SF, Kosch O, M de la Fuente J, Thanh NTK, Wiekhorst F, Pfeifer A. Quantification of Lipoprotein Uptake in Vivo Using Magnetic Particle Imaging and Spectroscopy.
ACS Nano. 2021 Jan 26;15(1):434-446. doi: 10.1021/acsnano.0c03229. Epub 2020 Dec
Cell Metabolism
Gnad T, Navarro G, Lahesmaa M, Reverte-Salisa L, Copperi F, Cordomi A, Naumann J, Hochhäuser A, Haufs-Brusberg S, Wenzel D, Suhr F, Jespersen NZ, Scheele C, Tsvilovskyy V, Brinkmann C, Rittweger J, Dani C, Kranz M, Deuther-Conrad W, Eltzschig HK, Niemi T, Taittonen M, Brust P, Nuutila P, Pardo L, Fleischmann BK, Blüher M, Franco R, Bloch W, Virtanen KA, Pfeifer A. Adenosine/A2B Receptor Signaling Ameliorates the Effects of Aging and Counteracts Obesity.
Cell Metab. 2020 Jul 7;32(1):56-70.e7. doi: 10.1016/j.cmet.2020.06.006. Epub 2020 Jun
Nature
Sukonina V, Ma H, Zhang W, Bartesaghi S, Subhash S, Heglind M, Foyn H, Betz MJ, Nilsson D, Lidell ME, Naumann J, Haufs-Brusberg S, Palmgren H, Mondal T, Beg M, Jedrychowski MP, Taskén K, Pfeifer A, Peng XR, Kanduri C, Enerbäck S.
FOXK1 and FOXK2 regulate aerobic glycolysis
Nature. 2019 Feb;566(7743):279-283. doi: 10.1038/s41586-019-0900-5. Epub 2019 Jan
Nature Communications
Chen Y, Buyel JJ*, Hanssen MJ, Siegel F, Pan R, Naumann J, Schell M, van der Lans A, Schlein C, Froehlich H, Heeren J, Virtanen KA, van Marken Lichtenbelt W, Pfeifer A. Exosomal microRNA miR-92a concentration in serum reflects human brown fat activity.
Nat Commun. 2016 Apr 27;7:11420. doi: 10.1038/ncomms11420.
Nature Communications
Hoffmann LS, Etzrodt J, Willkomm L, Sanyal A, Scheja L, Fischer AWC, Stasch JP, Bloch W, Friebe A, Heeren J, Pfeifer A. Stimulation of soluble guanylyl cyclase protects against obesity by recruiting brown adipose tissue.
Nat Commun. 2015 May 26;6:7235. doi: 10.1038/ncomms8235
Nature Communications
Chen Y, Siegel F, Kipschull S, Haas B, Fröhlich H, Meister G, Pfeifer A. miR-155 regulates differentiation of brown and beige adipocytes via a bistable circuit.
Nat Commun. 2013;4:1769.
Kommen Sie zu uns! Wir sind immer auf der Suche nach motivierten Kandidat*innen, die Interesse an einem Praktikum, einer Masterarbeit, Promotion oder Postdoc-Stelle haben. Schreiben Sie uns einfach an!
Aktuell ausgeschriebene Stellen finden Sie hier
Kontakt
Prof. Dr. Alexander Pfeifer
Venusberg Campus 1
53127 Bonn


